2024-04-02
2024年3月29日,聚焦于基因和細胞治療的上海邦耀生物科技有限公司(以下簡稱“邦耀生物”)與華東師范大學劉明耀、李大力、王立人團隊以及上海交通大學基礎醫學院曾凡一課題組合作,在國際知名期刊Nature Chemical Biology雜志發表了題為“Engineering APOBEC3A deaminase for highly accurate and efficient base editing”的研究論文,報道開發出了三個高精準型的胞嘧啶堿基編輯器——“haA3A-CBE”。這也是邦耀生物團隊繼2023年6月在國際著名學術期刊Nature Biotechnology報道新型腺嘌呤顛換編輯工具(AXBEs和ACBEs)后,一年不到的時間在單堿基編輯工具開發領域的又一重大技術突破。

Nature Chemical Biology 發文( 文章在線:https://www.nature.com/articles/s41589-024-01595-4 )
“haA3A-CBE”:高效精準,極低脫靶活性
單堿基基因編輯技術,顧名思義,指能在基因組上引起單個堿基改變的基因編輯技術,最早由哈佛大學David R. Liu團隊開發,主要分為兩類:胞嘧啶堿基編輯器(Cytosine base editor,CBE)與腺嘌呤堿基編輯器(Adenosinebase editor,ABE)。基本原理是將胞嘧啶脫氨酶(APOBEC)或腺苷脫氨酶與現存Cas9n(D10A)融合而形成,依賴于CRISPR原理使得靶點遠離PAM端的4-7位的單個堿基發生修改的基因編輯技術。近幾年,由于其技術的強大、高效,以及不直接產生雙鏈DNA斷裂等特點逐漸成為人們關注的熱點,目前CBE與ABE已被廣泛應用于動物基因工程、植物基因工程,并在基因治療中顯示出良好的潛力。 CBE由胞嘧啶脫氨酶、Cas9切口酶和尿嘧啶糖基化酶抑制劑(UGI)組成,然而,CBE的寬編輯窗口容易導致靶點內多個堿基被同時編輯,產生旁觀者編輯,大大降低了編輯精度。此外,胞嘧啶脫氨酶的單鏈DNA和RNA結合活性易導致隨機性DNA和RNA脫靶編輯,存在安全隱患。
為了開發能夠在多種序列背景下實現高效堿基編輯的精準型CBE,該研究團隊利用hAPOBEC3A構建了A3A-BE4max,并基于hAPOBEC3A的晶體結構進行理性設計,通過正交R-loop實驗篩選低脫靶活性突變體。

haA3A-CBE編輯器結構示意圖
綜合考慮靶向編輯活性,脫靶編輯活性和編輯窗口,將Y130A、VA和Y130G突變體選為高精準型A3A-CBE(haA3A-CBE),分別命名為haA3A-CBE-A、haA3A-CBE-VA和haA3A-CBE-G。為了進一步評價haA3A-CBE的編輯活性和窗口,研究者在多種序列背景下對它們進行了測試。結果顯示,haA3A-CBE在甲基化位點的編輯活性顯著高于YE1-BE4max,在GC和AC序列中的編輯效率顯著高于YE1-BE4max和eA3A-BE4max,它們的高活性窗口位于protospacer的6-7位。此外,研究者通過全基因組測序和RNA測序驗證了haA3A-CBE具有極低的脫靶活性。
潛力巨大!“haA3A-CBE”在體內基因治療前景可觀
點突變是引起人類遺傳病的主要原因之一,研究統計結果表明,在已知的與疾病相關的50000種人類基因變異中,有超過30000種基因突變都是由于單堿基的改變而導致疾病。因此,利用高編輯效率、不產生DNA雙鏈斷裂的單堿基編輯工具來進行遺傳疾病的基因治療是非常具有應用價值的。
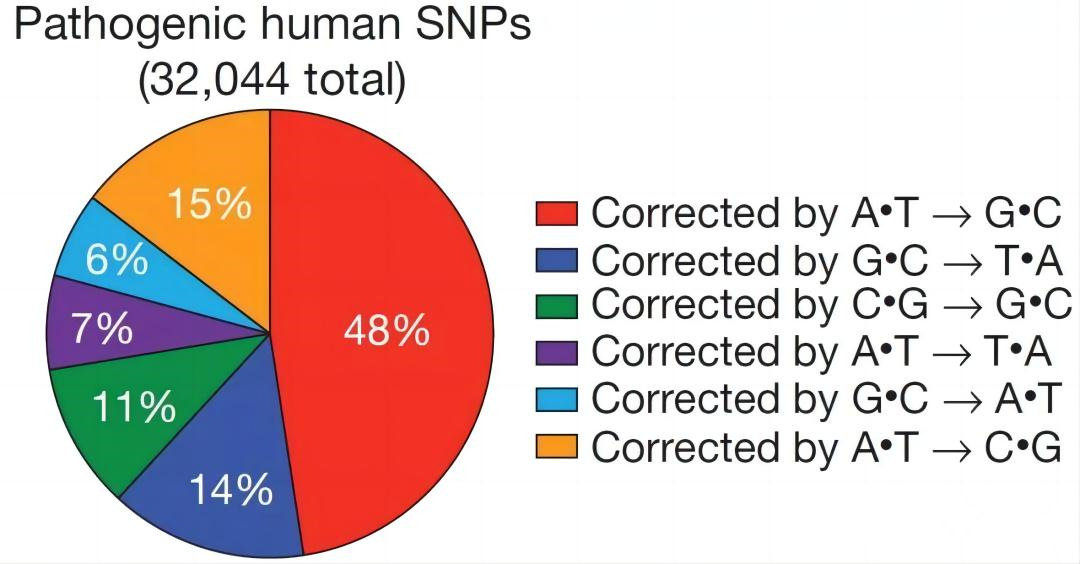
人類遺傳病中單堿基突變(SNVs)類型
為了評估haA3A-CBE在基因治療中的高效性和精準性,研究者構建了9個含有人類致病SNV的細胞系。經測試發現haA3A-CBE可以高效且精確地糾正其中6個SNV,并在兩個位于GC序列背景的SNV上展現出相對于YE1-BE4max 1.7-4.8倍和1.9-3.3倍的編輯效率。為了進一步測試haA3A-CBE的基因治療潛能,通過目前基因治療常用的腺相關病毒(adeno-associated virus,AAV)或脂質納米顆粒(lipid nanoparticles,LNP)遞送技術,在遺傳性酪氨酸血癥的小鼠模型體內實現了精準高效編輯,達到治愈的療效。

圖J.在LNP給藥后1周或6周,每只小鼠FahNS/NS等位基因的C到T編輯頻率。圖k. 在LNP給藥后1周或6周,FahNS/NS等位基因編輯類型與效率。
總的來說,haA3A-CBE具有窄編輯窗口和極低脫靶活性,更重要的是它們能夠在多種序列背景下實現高效堿基編輯,尤其是對甲基化位點和GC序列背景位點的C堿基具有高效編輯能力,豐富了堿基編輯工具箱,有望成為治療人類遺傳疾病非常有前景的編輯器。
邦耀生物突破不斷,為人類疾病帶來更優的治療選擇
邦耀生物作為一家全球最早進行基因編輯技術研發和應用的企業之一,自成立以來一直堅持技術創新,不僅不斷克服行業壁壘進行多管線戰略布局,同時致力于開發國際領先的基因編輯工具,獲得具有自主知識產權的核心技術。目前,邦耀生物科學家團隊在基因編輯工具開發、基因治療地中海貧血等遺傳疾病領域,已經取得很多重磅、突破性進展:
2023年6月,Nature Biotechnology發文,開發出精準高效的腺嘌呤顛換編輯器“ACBEs”;
2022年11月,Nature Biotechnology發文,開發出高精度新型胞嘧啶堿基編輯系統“Td-CGBE/Td-CBEs”;
2022年10月,Nature Chemical Biology發文,成功開發精準安全的新型腺嘌呤堿基編輯器“ABE9”;
2022年8月,Nature Medicine發文,公布了詳細的臨床數據,邦耀生物BRL-101基因治療地中海貧血癥患兒脫離輸血依賴已超過2年,并更為全面地解讀了BRL-101治療患者的療效和安全性特征;
2020年6月,Nature Biotechnology發文,開發一種全新的具有高特異性且安全的雙功能堿基編輯器“A&C-BEmax”;
2020年5月,Nature Cell Biology發文,報道自主研發的hyCBEs系列工具擁有更高的編輯活性和更寬的編輯窗口,對于β血紅蛋白病的治療具有更大的優勢;
2020年3月,Nature Medicine發文,證明單堿基編輯技術可以靶向BCL11A的紅系增強子原件激活胎兒期血紅蛋白,或者編輯β血紅蛋白基因的特定突變,有望通過編輯自體造血干細胞治療包括β-地中海貧血在內的遺傳性血液疾病;
2020年1月,Cell Research發文,率先證明單堿基編輯器編輯技術靶向HBG啟動子激活胎兒期血紅蛋白的表達對于治療β-地中海貧血的可行性與有效性;
2019年3月,Nature Medicine發文,發現利用基因編輯技術靶向編輯BCL11A紅系增強子,會重新開啟γ珠蛋白表達,代替有缺陷的β珠蛋白,有望達到根治β-地中海貧血目的;
2016年5月,EMBO Molecular Medicine發文,全球首次利用CRISPR基因編輯治療血友病。